3. Manfaat Unsur dan Senyawanya
1. Halogen

Kegunaannya:
CCl2F2 : Gas freon (freon–12) digunakan sebagai zat pendingin pada lemari es dan AC.
NaF : Natrium fluorida digunakan sebagai obat penguat pada kayu.
DDT : Dikloro Difenil Trikloro etana digunakan sebagai insektisida.
PVC : Polivinil klorida digunakan sebagai plastik untuk pipa pralon.
CaOCl2 : Digunakan sebagai serbuk pengelantang dan desinfektan.
NaClO : Kaporit sebagai serbuk pengelantang
KClO3 : Digunakan dalam industri korek api.
KCl : Digunakan untuk pupuk.
NaBr : Digunakan dalam kedokteran sebagai obat penenang.
Pembuatan:
Unsur-unsur halogen dapat dibuat dengan jalan oksidasi, reduksi, dan elektrolisis.
Klor :
– Oksidasi, Dengan memanaskan campuran MnO2, NaCl, dan H2SO4 pekat.
– Elektrolisis lebur NaCl menghasilkan gaS klor di anode.
– Elektrolisis lebur NaCl, dihasilkan gas Cl2 pada anode dan Na pada katode.
– Elektrolisis larutan NaCl dengan menggunakan diafragma, dihasilkan gas Cl2 pada anode dan NaOH pada katode.
Brom :
– Oksidasi, Dengan mengalirkan gas Cl2 ke dalam air laut.
Cl2(g) + 2 Br–(aq) —> 2 Cl–(aq) + Br2(aq)
Iodium :
– Reduksi
Dengan menambah NaHSO3 ke dalam larutan NaIO3
2 IO3–(aq) + 5 HSO3 –(aq) —>3 HSO4 –(aq) +2 SO42–(aq) + H2O(l) + I2(aq)
2. Nitrogen dan Oksigen

a. Nitrogen
Dalam keadaan bebas terdapat di udara (± 78%); dalam keadaan terikat sebagai KNO3 dan NaNO3 (sendawa Chili).
Pembuatan:
Dalam teknik/industri: dengan distilasi udara cair.
Dalam laboratorium : dengan memanaskan NH4NO2
NH4NO2(s) —> 2 H2O(l) + N2(g)
Senyawa yang penting:
NH3 : dibuat dengan Proses Haber–Bosch
N2(g) + 3 H2(g) —> 2 NH3(g)
Sebagai bahan baku pembuatan pupuk urea.
HNO3 (asam nitrat): dibuat dengan proses Ostwald.

b. Oksigen
Pembuatan oksigen:
1) Proses elektrolisis air.
2) Proses penyulingan udara.
3) Memanaskan garam tertentu dan oksida logam berat
2 KClO3(s) —>2 KCl(s) + 3 O2(g)
2 HgO(s) —> 2 Hg(l) + O2(g)
3. Alkali dan alkali tanah

a. Senyawa-senyawa alkali
NaOH : Disebut soda api. Digunakan sebagai bahan baku untuk pembuatan sabun, detergen, kertas, serat rayon.
Na2CO3: Natrium karbonat dikenal dengan nama soda. Digunakan dalam industri kaca, melunakkan air sadah dan menghilangkan noda minyak.
NaHCO3: Natrium bikarbonat juga disebut soda kue. Digunakan untuk pembuatan kue.
Pembuatan:
Logam alkali dibuat dengan elektrolisis cairan garamnya
(sebagai klorida).
Reaksi : LCl(l) –> L+ + Cl–
Katode : L+ + e– –> L
Anode : 2 Cl– –> Cl2 + 2 e–
b. Senyawa-senyawa alkali tanah

1) Magnesium oksida (MgO)
Digunakan untuk bahan gading tiruan, obat penyakit mag, dan pelapis tanur.
2) Magnesium sulfat berkristal (MgSO4.7H2O)
Digunakan sebagai obat kuras dengan nama garam inggris.
3) Kalsium oksida (CaO)
Kalsium oksida disebut juga kapur tohor atau gamping. Digunakan dalam industri besi, semen, soda, kaca.
4) Kalsium karbida (CaC2)
Kalsium karbida disebut juga karbit, digunakan untuk membuat gas asetilen.
5) Kalsium sulfat (CaSO4)
Kalsium sulfat yang mengandung 2 molekul air kristal disebut batu tahun (CaSO4.2H2O).
Pembuatan:
Logam alkali tanah dibuat dengan elektrolisis garam klorida cairannya.
MCl2 –> M2+ + 2 Cl–
Katode : M2+ + 2 e– –>M
Anode : 2 Cl– –>Cl2 + 2 e–
4. Unsur-unsur Periode Ketiga

Pembuatan dan kegunaannya
a. Natrium
Dibuat dengan cara elektrolisis leburan NaCl
Reaksi : NaCl(l) –>Na+ + Cl–
Katode : Na+ + e– –>Na
Anode : 2 Cl –> Cl2 + 2 e–
Natrium tidak dapat dibuat dengan elektrolisis air laut. Natrium disimpan dalam minyak tanah.
Kegunaannya:
Sebagai lampu penerangan di jalan-jalan raya. Natrium mempunyai kemampuan menembus kabut.
b. Magnesium
Dibuat dengan cara elektrolisis lelehan MgCl2.
Kegunaannya:
Untuk aliase (magnalium), digunakan untuk kerangka pesawat terbang dan lampu kilat dalam fotografi.
c. Aluminium
Dibuat dengan elektrolisis dari bauksit yang murni.
1) Al2O3 murni dicampur dengan Na3AIF (kriolit) untuk menurunkan titik leleh Al2O3 dan bertindak sebagai pelarut untuk pemurnian Al2O3.
2) Dielektrolisis, reaksi yang terjadi:
Al2O3 –>Al3+ + O2–
Katode (grafit) : 4 Al3+ + 12 e– –>4 Al
Anode (grafit) : 3 C + 6 O2– —>3 CO2 + 12 e–
3 C + 4 Al3+ + 6 O2– —>4 Al + 3 CO2
Anode sedikit demi sedikit akan habis.

d. Silikon
Dibuat dengan mereduksi SiO2 dengan karbon
30000C
SiO2 + C ——-> Si + 2CO
Kegunaannya:
– Bahan bakar pada pembuatan jenis-jenis gelas atau kaca.
– Bahan-bahan solar sel.
– Sebagai semikonduktor.
e. Fosfor
Dibuat dengan Proses Wohler
Dikenal dalam 2 bentuk alotropi, yaitu fosfor putih dan fosfor merah.
Kegunaannya:
– Bahan untuk membuat pupuk superfosfat.
– Bahan untuk membuat korek api.
f. Belerang
Terdapat bebas di alam, terutama di daerah gunung berapi. Dikenal dalam 2 bentuk alotropi, yaitu monoklin (di atas suhu 96 °C) dan rombik (di bawah suhu 96 °C).
Kegunaannya:
Sebagai bahan baku pembuatan asam sulfat H2SO4 (Proses Kontak dan Proses Kamar Timbal).
1) Asam sulfat (H2SO4)
Asam sulfat adalah zat cair kental, tak berwarna, bersifat sangat higroskopis. Asam sulfat dapat menarik hidrogen dan oksigen dari senyawanya dengan perbandingan 2 : 1. Senyawa-senyawa yang mengandung H dan O seperti gula, selulosa, dan kayu akan hangus bila dituangi asam sulfat pekat. Selain bersifat higroskopis, asam sulfat pekat merupakan oksidator kuat.
2) Pembuatan asam sulfat
Dalam dunia industri asam sulfat dibuat dengan2 cara, yaitu:
a) Menurut proses kontak.
b) Menurut proses bilik timbal/kamar timbal.
Proses kontak dengan proses kamar timbal mempunyai persamaan dan perbedaan.
1) Persamaan : bahan dasar SO2 dari pembakaran belerang.
2) Perbedaan : katalis yang digunakan pada proses kamar timbal adalah campuran NO dan NO2 (uap nietreusa).
Hasil kemurniannya:
1) Proses kontak : 98–100%
2) Proses kamar timbal : ± 77%
1) Proses kontak
Bahan baku asam sulfat adalah gas SO2 yang diperoleh dengan pemanggangan pirit atau pembakaran arang.
Reaksinya: 4 FeS2 + 11 O2 —> 2 Fe2O3 + 8 SO2 atau: S + O2 —> SO2
Gas belerang dioksidasi yang terjadi dicampur dengan udara dialirkan melalui katalisator kontak(V2O5) pada suhu ± 400 °C.
Dalam tanur kontak, gas SO2 + O2 diembuskan ke dalam tanur hingga bersentuhan dengan lempenglempeng yang dilapis V2O5 dalam tanur tersebut sebagai zat kontak.
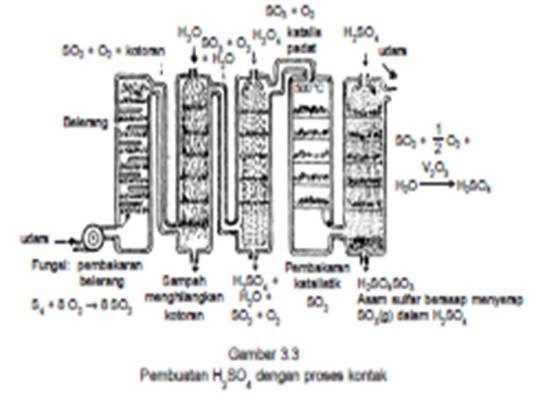
Dalam reaksi ini V2O5 tidak hanya bertindak sebagai katalis, tetapi juga bertindak sebagai oksidator. Oleh karena itu, dalam proses kontak V2O5 bertindak sebagai katalis oksidator. Gas SO3 yang terjadi dialirkan ke dalam larutan asam sulfat encer, sehingga terjadi asam pirosulfat.
Reaksinya: SO3 + H2SO4 —> H2S2O7
Dengan menambahkan air ke dalam campuran ini diperoleh asam sulfat pekat (98%).
Reaksinya: H2S2O7 + H2O —> 2 H2SO4
2) Proses bilik timbal
Bahan baku dalam proses ini sama seperti pada proses kontak yaitu gas SO2. Katalis yang digunakan pada proses ini ialah gas NO dan NO2. Gas SO2, NO, NO2, dan uap air dialirkan ke dalam ruang yang bagian dalamnya dilapisi Pb (timbal).
Reaksi yang terjadi:
2 S(s) + 2 O2(g) —> 2 SO2(g)
2 SO2(g) + 2 NO2(g) —> 2 SO3(g) + 2 NO(g)
2 SO3(g) + 2 H2O(l) —> 2 H2SO4(aq)
2 NO(g) + O2(g) —> 2 NO2(g)
Reaksi total:
2 S(s) + 2 O2(g) + 2 H2O(l) + 2 H2O(l) —>2 H2SO4(aq)

g. Klor
Dapat dibuat dengan elektrolisis leburan NaCl atau elektrolisis larutan NaCl dengan menggunakan diafragma.
Kegunaannya:
Sebagai desinfektan (Ca(OCl)2), pemutih NaClO.
h. Argon
Digunakan sebagai pengisi bola lampu listrik dalam pengelasan dan pencegahan perkaratan.
5. Unsur-Unsur Transisi


Kegunaannya:
CCl2F2 : Gas freon (freon–12) digunakan sebagai zat pendingin pada lemari es dan AC.
NaF : Natrium fluorida digunakan sebagai obat penguat pada kayu.
DDT : Dikloro Difenil Trikloro etana digunakan sebagai insektisida.
PVC : Polivinil klorida digunakan sebagai plastik untuk pipa pralon.
CaOCl2 : Digunakan sebagai serbuk pengelantang dan desinfektan.
NaClO : Kaporit sebagai serbuk pengelantang
KClO3 : Digunakan dalam industri korek api.
KCl : Digunakan untuk pupuk.
NaBr : Digunakan dalam kedokteran sebagai obat penenang.
Pembuatan:
Unsur-unsur halogen dapat dibuat dengan jalan oksidasi, reduksi, dan elektrolisis.
Klor :
– Oksidasi, Dengan memanaskan campuran MnO2, NaCl, dan H2SO4 pekat.
– Elektrolisis lebur NaCl menghasilkan gaS klor di anode.
– Elektrolisis lebur NaCl, dihasilkan gas Cl2 pada anode dan Na pada katode.
– Elektrolisis larutan NaCl dengan menggunakan diafragma, dihasilkan gas Cl2 pada anode dan NaOH pada katode.
Brom :
– Oksidasi, Dengan mengalirkan gas Cl2 ke dalam air laut.
Cl2(g) + 2 Br–(aq) —> 2 Cl–(aq) + Br2(aq)
Iodium :
– Reduksi
Dengan menambah NaHSO3 ke dalam larutan NaIO3
2 IO3–(aq) + 5 HSO3 –(aq) —>3 HSO4 –(aq) +2 SO42–(aq) + H2O(l) + I2(aq)
2. Nitrogen dan Oksigen

a. Nitrogen
Dalam keadaan bebas terdapat di udara (± 78%); dalam keadaan terikat sebagai KNO3 dan NaNO3 (sendawa Chili).
Pembuatan:
Dalam teknik/industri: dengan distilasi udara cair.
Dalam laboratorium : dengan memanaskan NH4NO2
NH4NO2(s) —> 2 H2O(l) + N2(g)
Senyawa yang penting:
NH3 : dibuat dengan Proses Haber–Bosch
N2(g) + 3 H2(g) —> 2 NH3(g)
Sebagai bahan baku pembuatan pupuk urea.
HNO3 (asam nitrat): dibuat dengan proses Ostwald.

b. Oksigen
Pembuatan oksigen:
1) Proses elektrolisis air.
2) Proses penyulingan udara.
3) Memanaskan garam tertentu dan oksida logam berat
2 KClO3(s) —>2 KCl(s) + 3 O2(g)
2 HgO(s) —> 2 Hg(l) + O2(g)
3. Alkali dan alkali tanah

a. Senyawa-senyawa alkali
NaOH : Disebut soda api. Digunakan sebagai bahan baku untuk pembuatan sabun, detergen, kertas, serat rayon.
Na2CO3: Natrium karbonat dikenal dengan nama soda. Digunakan dalam industri kaca, melunakkan air sadah dan menghilangkan noda minyak.
NaHCO3: Natrium bikarbonat juga disebut soda kue. Digunakan untuk pembuatan kue.
Pembuatan:
Logam alkali dibuat dengan elektrolisis cairan garamnya
(sebagai klorida).
Reaksi : LCl(l) –> L+ + Cl–
Katode : L+ + e– –> L
Anode : 2 Cl– –> Cl2 + 2 e–
b. Senyawa-senyawa alkali tanah

1) Magnesium oksida (MgO)
Digunakan untuk bahan gading tiruan, obat penyakit mag, dan pelapis tanur.
2) Magnesium sulfat berkristal (MgSO4.7H2O)
Digunakan sebagai obat kuras dengan nama garam inggris.
3) Kalsium oksida (CaO)
Kalsium oksida disebut juga kapur tohor atau gamping. Digunakan dalam industri besi, semen, soda, kaca.
4) Kalsium karbida (CaC2)
Kalsium karbida disebut juga karbit, digunakan untuk membuat gas asetilen.
5) Kalsium sulfat (CaSO4)
Kalsium sulfat yang mengandung 2 molekul air kristal disebut batu tahun (CaSO4.2H2O).
Pembuatan:
Logam alkali tanah dibuat dengan elektrolisis garam klorida cairannya.
MCl2 –> M2+ + 2 Cl–
Katode : M2+ + 2 e– –>M
Anode : 2 Cl– –>Cl2 + 2 e–
4. Unsur-unsur Periode Ketiga

Pembuatan dan kegunaannya
a. Natrium
Dibuat dengan cara elektrolisis leburan NaCl
Reaksi : NaCl(l) –>Na+ + Cl–
Katode : Na+ + e– –>Na
Anode : 2 Cl –> Cl2 + 2 e–
Natrium tidak dapat dibuat dengan elektrolisis air laut. Natrium disimpan dalam minyak tanah.
Kegunaannya:
Sebagai lampu penerangan di jalan-jalan raya. Natrium mempunyai kemampuan menembus kabut.
b. Magnesium
Dibuat dengan cara elektrolisis lelehan MgCl2.
Kegunaannya:
Untuk aliase (magnalium), digunakan untuk kerangka pesawat terbang dan lampu kilat dalam fotografi.
c. Aluminium
Dibuat dengan elektrolisis dari bauksit yang murni.
1) Al2O3 murni dicampur dengan Na3AIF (kriolit) untuk menurunkan titik leleh Al2O3 dan bertindak sebagai pelarut untuk pemurnian Al2O3.
2) Dielektrolisis, reaksi yang terjadi:
Al2O3 –>Al3+ + O2–
Katode (grafit) : 4 Al3+ + 12 e– –>4 Al
Anode (grafit) : 3 C + 6 O2– —>3 CO2 + 12 e–
3 C + 4 Al3+ + 6 O2– —>4 Al + 3 CO2
Anode sedikit demi sedikit akan habis.

d. Silikon
Dibuat dengan mereduksi SiO2 dengan karbon
30000C
SiO2 + C ——-> Si + 2CO
Kegunaannya:
– Bahan bakar pada pembuatan jenis-jenis gelas atau kaca.
– Bahan-bahan solar sel.
– Sebagai semikonduktor.
e. Fosfor
Dibuat dengan Proses Wohler
Dikenal dalam 2 bentuk alotropi, yaitu fosfor putih dan fosfor merah.
Kegunaannya:
– Bahan untuk membuat pupuk superfosfat.
– Bahan untuk membuat korek api.
f. Belerang
Terdapat bebas di alam, terutama di daerah gunung berapi. Dikenal dalam 2 bentuk alotropi, yaitu monoklin (di atas suhu 96 °C) dan rombik (di bawah suhu 96 °C).
Kegunaannya:
Sebagai bahan baku pembuatan asam sulfat H2SO4 (Proses Kontak dan Proses Kamar Timbal).
1) Asam sulfat (H2SO4)
Asam sulfat adalah zat cair kental, tak berwarna, bersifat sangat higroskopis. Asam sulfat dapat menarik hidrogen dan oksigen dari senyawanya dengan perbandingan 2 : 1. Senyawa-senyawa yang mengandung H dan O seperti gula, selulosa, dan kayu akan hangus bila dituangi asam sulfat pekat. Selain bersifat higroskopis, asam sulfat pekat merupakan oksidator kuat.
2) Pembuatan asam sulfat
Dalam dunia industri asam sulfat dibuat dengan2 cara, yaitu:
a) Menurut proses kontak.
b) Menurut proses bilik timbal/kamar timbal.
Proses kontak dengan proses kamar timbal mempunyai persamaan dan perbedaan.
1) Persamaan : bahan dasar SO2 dari pembakaran belerang.
2) Perbedaan : katalis yang digunakan pada proses kamar timbal adalah campuran NO dan NO2 (uap nietreusa).
Hasil kemurniannya:
1) Proses kontak : 98–100%
2) Proses kamar timbal : ± 77%
1) Proses kontak
Bahan baku asam sulfat adalah gas SO2 yang diperoleh dengan pemanggangan pirit atau pembakaran arang.
Reaksinya: 4 FeS2 + 11 O2 —> 2 Fe2O3 + 8 SO2 atau: S + O2 —> SO2
Gas belerang dioksidasi yang terjadi dicampur dengan udara dialirkan melalui katalisator kontak(V2O5) pada suhu ± 400 °C.
Dalam tanur kontak, gas SO2 + O2 diembuskan ke dalam tanur hingga bersentuhan dengan lempenglempeng yang dilapis V2O5 dalam tanur tersebut sebagai zat kontak.

Dalam reaksi ini V2O5 tidak hanya bertindak sebagai katalis, tetapi juga bertindak sebagai oksidator. Oleh karena itu, dalam proses kontak V2O5 bertindak sebagai katalis oksidator. Gas SO3 yang terjadi dialirkan ke dalam larutan asam sulfat encer, sehingga terjadi asam pirosulfat.
Reaksinya: SO3 + H2SO4 —> H2S2O7
Dengan menambahkan air ke dalam campuran ini diperoleh asam sulfat pekat (98%).
Reaksinya: H2S2O7 + H2O —> 2 H2SO4
2) Proses bilik timbal
Bahan baku dalam proses ini sama seperti pada proses kontak yaitu gas SO2. Katalis yang digunakan pada proses ini ialah gas NO dan NO2. Gas SO2, NO, NO2, dan uap air dialirkan ke dalam ruang yang bagian dalamnya dilapisi Pb (timbal).
Reaksi yang terjadi:
2 S(s) + 2 O2(g) —> 2 SO2(g)
2 SO2(g) + 2 NO2(g) —> 2 SO3(g) + 2 NO(g)
2 SO3(g) + 2 H2O(l) —> 2 H2SO4(aq)
2 NO(g) + O2(g) —> 2 NO2(g)
Reaksi total:
2 S(s) + 2 O2(g) + 2 H2O(l) + 2 H2O(l) —>2 H2SO4(aq)

g. Klor
Dapat dibuat dengan elektrolisis leburan NaCl atau elektrolisis larutan NaCl dengan menggunakan diafragma.
Kegunaannya:
Sebagai desinfektan (Ca(OCl)2), pemutih NaClO.
h. Argon
Digunakan sebagai pengisi bola lampu listrik dalam pengelasan dan pencegahan perkaratan.
5. Unsur-Unsur Transisi

Tidak ada komentar:
Posting Komentar